Qual O Item Que Apresenta Exemplos De Ligaçao Ionica? Descubra aqui os tipos de ligações iônicas, suas propriedades e aplicações. Entenda como elas diferem das ligações covalentes e metálicas.
As ligações iônicas são formadas pela transferência de elétrons entre átomos, resultando em íons positivos e negativos. Esses íons se atraem eletrostaticamente, formando compostos iônicos.
Tipos de Ligações Iônicas: Qual O Item Que Apresenta Exemplos De Ligaçao Ionica
As ligações iônicas são um tipo de ligação química que ocorre entre átomos de elementos metálicos e átomos de elementos não metálicos. Essas ligações são formadas pela transferência de elétrons de um átomo para outro, resultando na formação de íons.
Formação de Íons Positivos e Negativos
Quando um átomo metálico perde um ou mais elétrons, ele se transforma em um íon positivo, também conhecido como cátion. Por outro lado, quando um átomo não metálico ganha um ou mais elétrons, ele se transforma em um íon negativo, também conhecido como ânion.
A formação de íons é impulsionada pela diferença de eletronegatividade entre os átomos envolvidos. A eletronegatividade é uma medida da capacidade de um átomo de atrair elétrons. Quando a diferença de eletronegatividade entre dois átomos é grande, é mais provável que ocorra a transferência de elétrons.
Propriedades das Ligações Iônicas
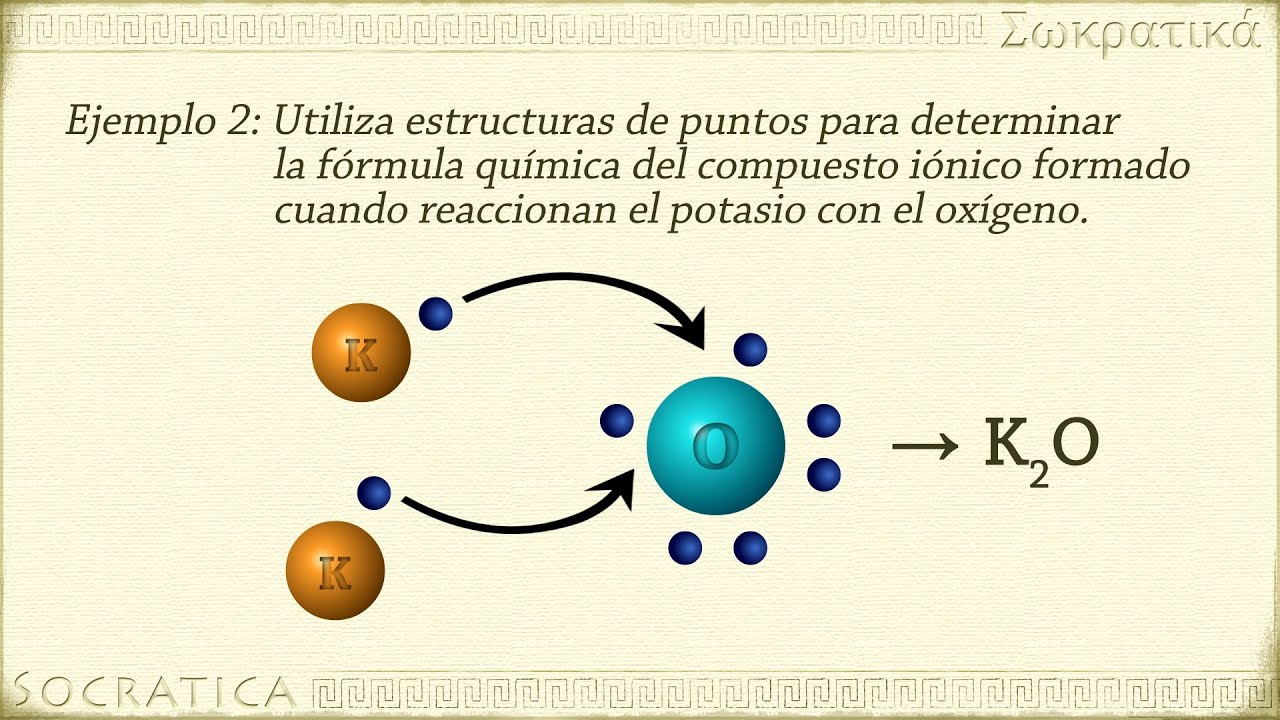
As ligações iônicas conferem propriedades distintas aos compostos que as apresentam. Essas propriedades resultam da forte atração eletrostática entre os íons positivos e negativos.
Propriedades Físicas
Os compostos iônicos são geralmente sólidos cristalinos com pontos de fusão e ebulição elevados. A forte atração eletrostática entre os íons dificulta a separação, o que explica os altos pontos de fusão e ebulição.
Alta Solubilidade em Água
Os compostos iônicos são altamente solúveis em água. Quando dissolvidos, os íons se dissociam, formando uma solução eletrolítica. A água é um solvente polar, o que significa que possui regiões positivas e negativas. Essas regiões interagem com os íons carregados, solvatando-os e facilitando sua dissolução.
Alta Condutividade Elétrica
Os compostos iônicos fundidos ou em solução conduzem eletricidade. Quando dissolvidos, os íons se movem livremente na solução, transportando carga elétrica. Da mesma forma, em estado fundido, os íons se tornam móveis e permitem a condução de eletricidade.
Aplicações das Ligações Iônicas

As ligações iônicas desempenham um papel crucial em vários aspectos de nossas vidas, incluindo indústrias, produtos de consumo e até mesmo em nossos próprios corpos.
Aplicações Industriais
Os compostos iônicos são amplamente utilizados em processos industriais devido às suas propriedades únicas. Por exemplo:
- O cloreto de sódio (NaCl) é usado como matéria-prima para a produção de cloro e hidróxido de sódio, essenciais para a indústria química.
- O carbonato de cálcio (CaCO3) é usado na fabricação de cimento, cal e vidro.
- O óxido de magnésio (MgO) é usado como refratário em fornos de alta temperatura e na produção de tijolos.
Produtos de Consumo
Os compostos iônicos também são encontrados em vários produtos de consumo, incluindo:
- Sal de cozinha (NaCl)
- Bicarbonato de sódio (NaHCO3) como fermento em pó
- Pasta de dente (fluoreto de sódio (NaF))
- Sabão (estearato de sódio (C18H35O2Na))
Biologia e Medicina
As ligações iônicas também são essenciais para os processos biológicos. Por exemplo:
- Os íons sódio (Na+) e potássio (K+) são essenciais para a transmissão de impulsos nervosos.
- Os íons cálcio (Ca2+) são cruciais para a contração muscular e a coagulação sanguínea.
- Os íons cloreto (Cl-) ajudam a manter o equilíbrio de fluidos no corpo.
Comparação com Outros Tipos de Ligações

As ligações iônicas diferem significativamente de outros tipos de ligações químicas, como ligações covalentes e metálicas. Compreender essas diferenças é crucial para entender a química dos compostos iônicos.
Ligações Iônicas e Covalentes, Qual O Item Que Apresenta Exemplos De Ligaçao Ionica
As ligações iônicas e covalentes são dois tipos fundamentais de ligações químicas. As ligações covalentes envolvem o compartilhamento de elétrons entre átomos, enquanto as ligações iônicas envolvem a transferência completa de elétrons de um átomo para outro.
Semelhanças:
- Ambas as ligações são atrações eletrostáticas entre partículas carregadas.
- Ambas as ligações podem formar moléculas ou compostos estáveis.
Diferenças:
- As ligações iônicas envolvem a transferência de elétrons, enquanto as ligações covalentes envolvem o compartilhamento de elétrons.
- As ligações iônicas formam-se entre íons com cargas opostas, enquanto as ligações covalentes formam-se entre átomos com eletronegatividade semelhante.
- As ligações iônicas são geralmente mais fortes do que as ligações covalentes.
Ligações Iônicas e Metálicas
As ligações iônicas e metálicas também diferem em vários aspectos.
Semelhanças:
- Ambas as ligações são atrações eletrostáticas entre partículas carregadas.
Diferenças:
- As ligações iônicas envolvem a transferência de elétrons, enquanto as ligações metálicas envolvem o compartilhamento de elétrons deslocalizados.
- As ligações iônicas formam-se entre íons com cargas opostas, enquanto as ligações metálicas formam-se entre átomos metálicos.
- As ligações iônicas são geralmente mais fortes do que as ligações metálicas.
Tabela de Comparação
A tabela a seguir resume as características distintivas das ligações iônicas, covalentes e metálicas:
| Característica | Ligação Iônica | Ligação Covalente | Ligação Metálica |
|---|---|---|---|
| Tipo de Interação | Transferência de elétrons | Compartilhamento de elétrons | Compartilhamento de elétrons deslocalizados |
| Natureza dos Átomos Envolvidos | Metais e não metais | Não metais | Metais |
| Força da Ligação | Forte | Moderada a forte | Fraca a moderada |
| Condutividade Elétrica | Conduz em estado fundido ou em solução | Não conduz | Conduz |
| Ponto de Fusão e Ebulição | Elevados | Baixos a moderados | Baixos a moderados |
Fatores que Afetam a Força das Ligações Iônicas

A força de uma ligação iônica é influenciada por vários fatores, incluindo o tamanho dos íons, a carga dos íons e a distância entre os íons.
Tamanho do Íon
Quanto maior o tamanho do íon, mais fraca a ligação iônica. Isso ocorre porque íons maiores têm uma densidade de carga menor, o que significa que a força de atração entre os íons é menor.
Por exemplo, a ligação iônica entre Na +e Cl –é mais forte do que a ligação iônica entre K +e Cl –porque o íon Na +é menor que o íon K +.
Carga do Íon
Quanto maior a carga dos íons, mais forte a ligação iônica. Isso ocorre porque íons com cargas mais altas têm uma força de atração maior entre si.
Por exemplo, a ligação iônica entre Mg 2+e O 2-é mais forte do que a ligação iônica entre Na +e Cl –porque o íon Mg 2+tem uma carga mais alta que o íon Na +.
Distância entre os Íons
Quanto menor a distância entre os íons, mais forte a ligação iônica. Isso ocorre porque a força de atração entre os íons é inversamente proporcional ao quadrado da distância entre eles.
Por exemplo, a ligação iônica entre Na +e Cl –em um cristal de NaCl é mais forte do que a ligação iônica entre Na +e Cl –em uma solução aquosa porque os íons estão mais próximos um do outro no cristal.
As ligações iônicas desempenham um papel crucial em vários aspectos de nossa vida, desde a produção de sais de cozinha até o funcionamento de baterias. Compreender suas características e aplicações é essencial para apreciar a diversidade do mundo químico.
FAQ Summary
O que são ligações iônicas?
Ligações iônicas são formadas quando um átomo transfere elétrons para outro átomo, criando íons positivos e negativos que se atraem eletrostaticamente.
Quais são alguns exemplos de compostos iônicos?
Exemplos comuns incluem cloreto de sódio (sal de cozinha), óxido de magnésio e cloreto de potássio.
Como as ligações iônicas diferem das ligações covalentes?
Nas ligações iônicas, os elétrons são transferidos completamente, enquanto nas ligações covalentes eles são compartilhados entre os átomos.

