Teoria E Modelo Atômico De Bohr – Toda Matéria: embarque conosco nessa jornada fascinante pelo microcosmo! Desvendaremos os mistérios da estrutura atômica, desde as primeiras teorias rudimentares até a elegante proposta de Niels Bohr, que revolucionou nossa compreensão da matéria. Exploraremos a evolução dos modelos atômicos, comparando as contribuições de Dalton, Thomson, Rutherford e, finalmente, a brilhante concepção de Bohr, com seus níveis de energia e órbitas estacionárias.
Prepare-se para uma viagem inspiradora ao coração da física e da química!
A compreensão do átomo, a unidade fundamental da matéria, é um pilar da ciência moderna. O modelo de Bohr, apesar de suas limitações, representa um marco crucial nessa jornada, oferecendo uma explicação elegante, embora simplificada, para o comportamento da luz emitida pelos átomos e abrindo caminho para o desenvolvimento da mecânica quântica. Veremos como esse modelo, apesar de não ser completamente preciso para átomos complexos, ilumina a relação entre a estrutura atômica e as propriedades periódicas dos elementos, fornecendo uma base fundamental para a compreensão das reações químicas e das propriedades da matéria em si.
A elegância e a simplicidade do modelo de Bohr, mesmo com suas imperfeições, continuam a inspirar e a cativar.
Aplicações e Limitações do Modelo de Bohr
O modelo atômico de Bohr, apesar de suas limitações, representou um salto monumental na compreensão da estrutura atômica, fornecendo uma explicação elegante, embora simplificada, para o comportamento da matéria em nível microscópico. Sua principal aplicação reside na interpretação dos espectros atômicos, abrindo caminho para uma nova era na física e na química. Mas, como toda teoria científica, ele apresenta limitações que revelam a complexidade ainda maior do mundo quântico.
O modelo de Bohr, com suas órbitas eletrônicas quantizadas, explica de forma brilhante a emissão de luz por átomos excitados. Imagine um elétron saltando de um nível de energia mais alto para um nível mais baixo. Essa transição energética é acompanhada pela liberação de um fóton, um pacote de luz, cuja energia corresponde exatamente à diferença entre os níveis energéticos.
A frequência da luz emitida, e portanto sua cor, é determinada por essa diferença, resultando em espectros de linhas características para cada elemento. O espectro de linhas do hidrogênio, por exemplo, com suas séries de Lyman, Balmer e Paschen, é perfeitamente explicado pelo modelo de Bohr, validando sua premissa de níveis de energia discretos.
Espectros Atômicos e o Modelo de Bohr
A capacidade do modelo de Bohr em prever com precisão as frequências das linhas espectrais do átomo de hidrogênio foi uma de suas maiores conquistas. A fórmula de Rydberg, derivada do modelo,
ΔE = hν = RH (1/n f²1/n i²)
onde R H é a constante de Rydberg, n i e n f são os níveis de energia inicial e final, respectivamente, permitiu a previsão precisa dos comprimentos de onda da luz emitida pelo hidrogênio. Essa concordância entre teoria e experimento foi crucial para a aceitação inicial do modelo. Para átomos mais complexos, porém, a precisão diminui consideravelmente.
Limitações do Modelo de Bohr
O modelo de Bohr, apesar de seu sucesso com o hidrogênio, falha ao descrever átomos com mais de um elétron. Ele não consegue explicar a intensidade relativa das linhas espectrais, nem a estrutura fina dos espectros. A interação entre os elétrons, ignorada no modelo, introduz complexidades que o modelo simplificado não consegue abordar. Além disso, o modelo falha ao prever o comportamento de átomos em campos magnéticos (efeito Zeeman) e a existência de spins eletrônicos.
A concepção de órbitas eletrônicas bem definidas, como planetas orbitando o Sol, é uma simplificação excessiva da realidade quântica, onde a localização precisa do elétron é probabilística, regida pela função de onda.
Precisão para Átomos Simples e Complexos
O modelo de Bohr demonstra alta precisão para o átomo de hidrogênio, um sistema simples com apenas um próton e um elétron. No entanto, sua precisão decai drasticamente à medida que a complexidade atômica aumenta. Átomos com múltiplos elétrons exibem interações eletrônicas complexas que o modelo não consegue representar adequadamente. As previsões espectrais para esses átomos divergem significativamente das observações experimentais.
Contribuição para a Mecânica Quântica, Teoria E Modelo Atômico De Bohr – Toda Matéria
Apesar de suas limitações, o modelo de Bohr desempenhou um papel crucial no desenvolvimento da mecânica quântica. Ele introduziu conceitos fundamentais como a quantização da energia e a existência de níveis de energia discretos, que são pilares da mecânica quântica moderna. O modelo serviu como um trampolim, um passo intermediário, para teorias mais completas e precisas, como a mecânica ondulatória de Schrödinger.
Pontos Fortes e Fracos do Modelo de Bohr
É importante reconhecer tanto os sucessos quanto as deficiências do modelo para compreender seu impacto histórico e suas limitações intrínsecas.
- Pontos Fortes: Explicação satisfatória do espectro de linhas do hidrogênio; introdução do conceito de quantização da energia; base para o desenvolvimento de teorias mais sofisticadas.
- Pontos Fracos: Inabilidade de explicar átomos polieletrônicos; não considera a interação entre elétrons; não prevê a estrutura fina dos espectros; modelo clássico de órbitas eletrônicas, incompatível com a natureza probabilística da mecânica quântica.
O Modelo de Bohr e a Matéria: Teoria E Modelo Atômico De Bohr – Toda Matéria
O modelo atômico de Bohr, apesar de suas limitações, revolucionou nossa compreensão da matéria, oferecendo uma imagem simplificada, porém poderosa, da estrutura atômica. Ele nos permitiu transcender a visão puramente clássica do átomo e adentrar no fascinante mundo da mecânica quântica, abrindo portas para uma explicação mais precisa das propriedades dos elementos e suas interações. Sua elegância reside na capacidade de conectar conceitos aparentemente abstratos com fenômenos observáveis, como as linhas espectrais dos elementos.O modelo de Bohr descreve o átomo como um minúsculo sistema solar, com um núcleo positivo no centro e elétrons orbitando-o em níveis de energia específicos e quantizados.
Essa quantização da energia, uma ideia revolucionária para a época, é a chave para entender a estabilidade do átomo e as propriedades da matéria. A impossibilidade de os elétrons caírem no núcleo, previsto pela física clássica, é resolvida pela restrição dos elétrons a órbitas específicas, com energias definidas. A transição entre essas órbitas explica a emissão e absorção de luz, fenômeno que até então era um mistério.
A Estrutura da Matéria segundo Bohr
O modelo de Bohr proporciona uma visão clara e concisa da estrutura da matéria, demonstrando como os átomos são construídos. A organização dos elétrons em níveis de energia discretos explica a periodicidade das propriedades químicas dos elementos. Elementos com o mesmo número de elétrons na camada de valência apresentam propriedades químicas semelhantes, como demonstrado na tabela periódica. A configuração eletrônica, prevista pelo modelo, determina a reatividade e as características químicas de cada elemento.
Por exemplo, os gases nobres, com suas camadas de valência completas, são extremamente estáveis e pouco reativos, enquanto os metais alcalinos, com um elétron na camada de valência, são altamente reativos.
O Modelo de Bohr e as Propriedades Periódicas dos Elementos
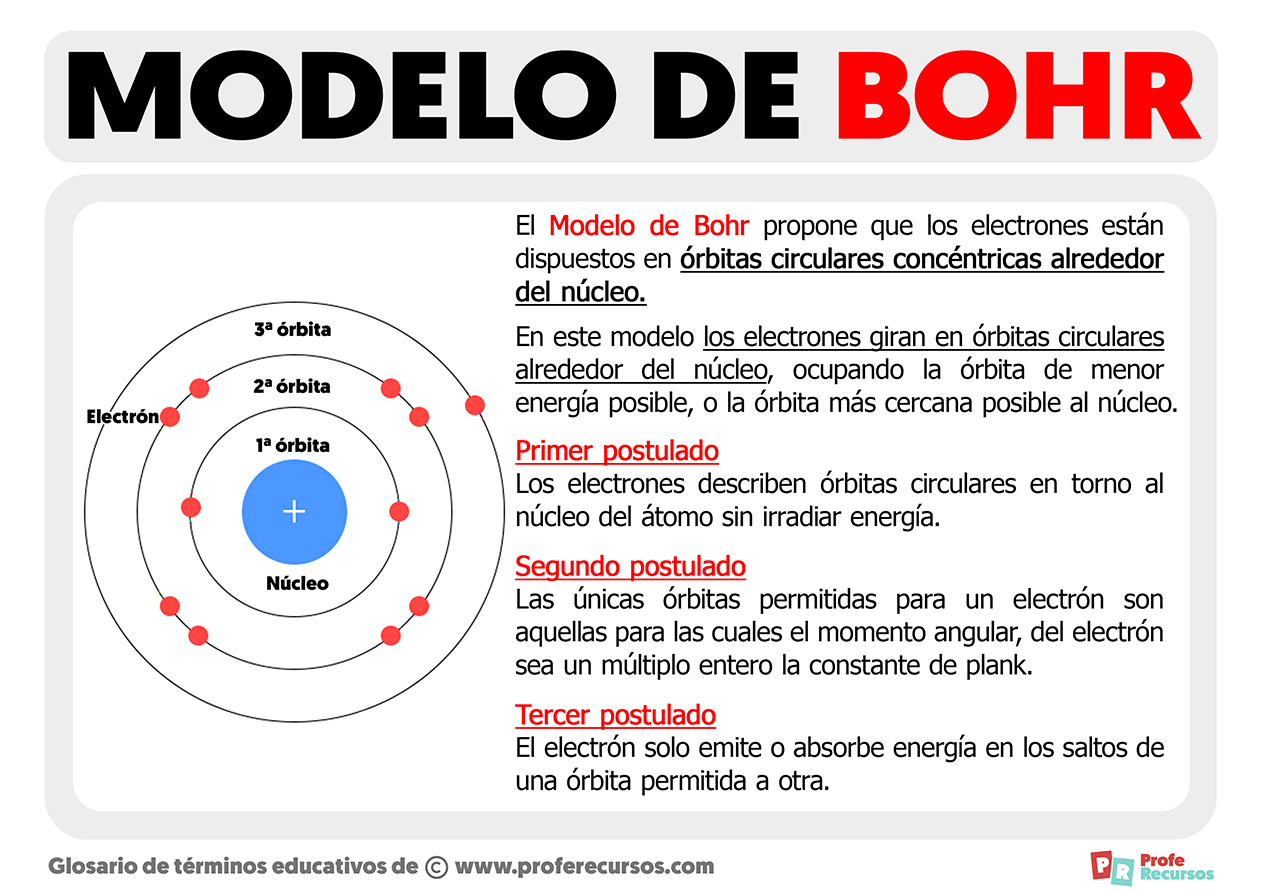
A relação entre o modelo de Bohr e as propriedades periódicas dos elementos é fundamental. A disposição dos elétrons em camadas eletrônicas, com diferentes níveis de energia, determina a reatividade e as propriedades químicas de cada elemento. Elementos com o mesmo número de elétrons na camada mais externa (camada de valência) pertencem ao mesmo grupo na tabela periódica e compartilham propriedades químicas semelhantes.
O modelo explica, por exemplo, por que os elementos do grupo 1 (metais alcalinos) são altamente reativos, tendendo a perder um elétron para atingir a configuração eletrônica de um gás nobre, enquanto os elementos do grupo 17 (halogênios) são também altamente reativos, tendendo a ganhar um elétron para alcançar a mesma configuração estável. A periodicidade observada nas propriedades dos elementos é uma consequência direta da estrutura atômica proposta por Bohr.
O Modelo de Bohr e as Reações Químicas
O modelo de Bohr contribui significativamente para a compreensão das reações químicas. As reações químicas envolvem a reorganização dos elétrons na camada de valência dos átomos. A tendência dos átomos em alcançar uma configuração eletrônica estável, semelhante à dos gases nobres (regra do octeto), explica a formação de ligações químicas. O modelo permite prever a formação de íons, a formação de ligações covalentes e iônicas, e a geometria das moléculas.
Por exemplo, a formação do cloreto de sódio (NaCl) pode ser explicada pela transferência de um elétron do sódio (Na) para o cloro (Cl), resultando em íons Na+ e Cl-, que são atraídos eletrostaticamente, formando um composto iônico.
Implicações do Modelo de Bohr para a Química e a Física
O modelo de Bohr teve um impacto profundo tanto na química quanto na física. Na química, ele forneceu uma base para a compreensão da ligação química, da estrutura molecular e das propriedades periódicas dos elementos, possibilitando a previsão do comportamento químico dos átomos. Na física, ele introduziu o conceito de quantização da energia, um princípio fundamental da mecânica quântica, que revolucionou nossa compreensão do mundo microscópico.
Embora simplificado, o modelo serviu como um elo crucial entre a física clássica e a física moderna, pavimentando o caminho para modelos atômicos mais complexos e precisos.
Representação do Átomo de Hidrogênio segundo Bohr

O átomo de hidrogênio, com seu único próton e um único elétron, é o exemplo mais simples e elucidativo do modelo de Bohr. Imagine um pequeno núcleo positivo no centro, representando o próton. Em torno desse núcleo, o elétron orbita em uma trajetória circular bem definida, a uma distância específica. Essa órbita corresponde ao nível de energia mais baixo (estado fundamental) do átomo de hidrogênio.
A representação visual seria um pequeno ponto (o próton) no centro de um círculo maior, com um ponto menor (o elétron) movendo-se ao longo desse círculo. A distância entre o núcleo e o elétron representa o raio da órbita, e a velocidade do elétron é tal que a força centrípeta equilibra a força de atração eletrostática entre o próton e o elétron.
É importante lembrar que essa é uma representação simplificada; a realidade é mais complexa, descrita pela mecânica quântica. Mas o modelo de Bohr nos dá uma imagem intuitiva e útil para compreender a estrutura atômica básica.

